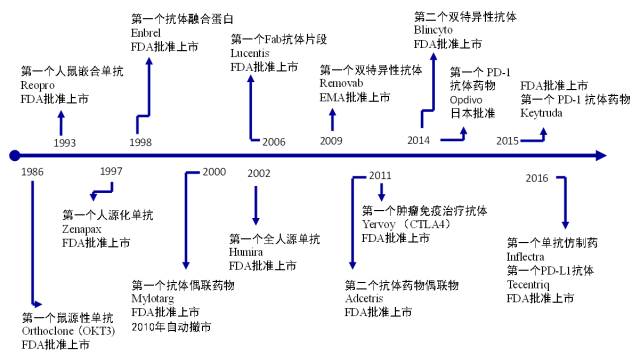
近二十年来,生物技术药物得以迅猛发展。根据BCC Research的一份报告,生物制剂的全球销售额在2015年达到2000亿美元,到2019年底预计将超过3860亿美元。其中,抗体类药物占据巨大份额。过去30年中,共有63个抗体药物进入市场。抗体药物发展进程中有一些重要里程碑式的事件,具体请见图1。
如何进行系统性药理学评价是抗体药物的一个重要课题。药理学是研究机体与药物相互作用的一门科学,药物对机体的作用主要表现为有效性以及安全性,而机体对药物的作用则归属于药代动力学的研究范畴,包括吸收、分布、代谢及排泄等体内处置过程。药代动力学是诠释药物有效性及安全性的物质基础,其重要性毋庸置疑。由于药代动力学研究药物标的本身为分析物,追踪其体内复杂的动态过程,其难度与观察药物对机体的效应是截然不同的。而生物分析技术作为PK研究的技术支撑,具有决定性意义。然而生物分析技术常常会遇到很多“难关”或“瓶颈”性问题。特别是有别于小分子药物,抗体类药物具体与内源性分子相似、表观分子不一致、结构不确定性以及非预期的多向活性等特点,因而在生物体内的药物处置机制有其特殊性和复杂性,极大的增加了研究难度。在药代动力学研究过程中,还存在另外一个问题即抗药性抗体(ADA)评价,ADA可能会对PK研究结果产生显著性影响,如何对ADA进行系统性、科学性评价是目前的迫切性课题。特别是随着抗体工程技术的发展,抗体研发趋势已经不局限于鼠源向人源化、全人抗体的发展,更趋于多功能化(双/多特异性抗体)、小型化(以雷珠单抗为代表的抗体片段)和精准化(抗体药物偶联物(ADC))方向的研发。抗体类别多样性的产生,不仅需要多种分析方法及平台技术的组合,更是对精确和强健的生物分析方法的开发和验证的需求日益增长,并要求产生的数据经得起监管审查。本文将简要回顾抗体药物PK、ADA的评价的法规和分析应对策略两方面的进展历程,以及浅谈国内相关领域行业发展现状。
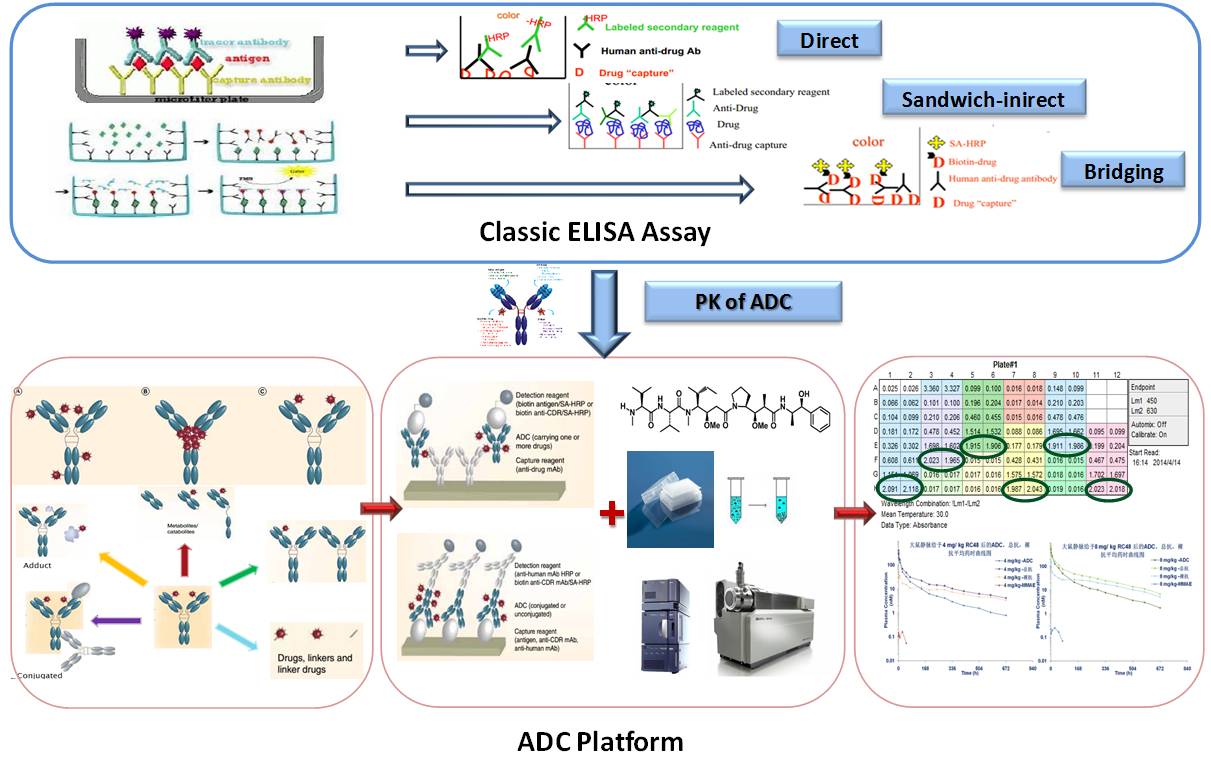
对于生物大分子药物分析方法,可能为大众所熟知的即是传统的酶联免疫吸附方法(ELISA),但如何建立一个满足药物评价需求及符合法规要求的方法并不是任何一个实验室都能轻易实现的,其需要大量理论及实践经验的反复“磨练”。而且,由于ELISA方法受到通量低、灵敏度低、方法稳定性以及关键试剂(包被抗体和检测抗体)难以获取等技术性壁垒,新技术平台正在不断的出现如MSD、Gyros、Singulex、multiplex、Biacore等,此外LC-MS/MS对抗体定量分析的研究也获得较大的发展,为多样化类型抗体类药物的PK评价提供有力保障(图2)。
方法学验证是整个试验数据可靠的基本保证,建立严密客观的方法学验证的标准是药动学研究的基础,是获得科学客观结果的基本保障。随着生物分析技术的不断更新以及在生物分析领域经验的不断累积,人们也在不断的检验现有方法学规范性的科学性及适用性,从而推动方法学行业标准经历了动态发展历程。
1990年之前方法验证没有统一的行业标准,历时十年经过两次生物分析方法验证研讨会的召开,FDA于2001年发布第一版方法学验证指导原则,并于2013年起草了新的方法学验证草案;欧盟药物机构(EMA)从2008年始筹划对生物分析方法验证的规范,共经历了概念性文件、指导文件草案(2009年)、征集意见和最终公布等阶段于2012年发布生物分析方法学验证法规;该指导原则首次全面、明确提出了生物大分子药物分析方法验证的指标和接受标准。尽管我国药物研发滞后于西方发达国家,但近年来发展速度可谓惊人,特别是中国国家食品药品监督管理总局(CFDA)于2015年在药典中对生物分析方法学验证的条目进行了系统的规定,这代表我国国家标准已经逐渐与世界接轨,对推动我国PK生物分析发展具有重要意义。
抗体药物研发过程中最大的关注点之一是其是否可能诱导产生抗药性抗体(anti-drug antibody,ADA)。抗药性抗体能对药物暴露、药物代谢动力学、药物效应动力学等造成影响,甚至引发严重安全性事件,尤其是对内源性成分药物而言,后果往往更为严重,如 EPO类药物产生的抗体能中和内源性EPO导致的PRCA,外源性IFN-β引起的中和抗体与内源IFN β形成免疫复合物而激活补体,长效VII因子引起的中和抗体导致加重原有出血倾向等。因此抗体药物的免疫原性引起了临床医生、药企及监管机构的高度关注。为了评估生物药物的免疫原性,以及将实验结果与相关事件联系起来,在临床前研究和临床研究中,开发可靠的能够有效评估抗药抗体的分析方法至关重要。
由于抗药性抗体的产生具有阶段性特点,不同时间段的抗体亚型存在差异性的;而且机体在给药后药物以及内源性分子浓度水平的“干扰”均会影响分析结果,故抗药性抗体分析方法应准确、灵敏、特异、耐用,能检测出包括IgG和IgM等所有亚型,同时基于风险采用多层次检测策略评价ADA,按照筛选分析、确证分析、中和分析等进行逐层分析(图3)。目前推荐使用的方法有直接或桥接酶联免疫吸附分析(ELISA)、放射免疫沉淀分析(RIPA)、表面等离子体共振(SPR)等,而目前免疫原性的研究已经拓展到了诸如MSD、Gyros、Singulex等更先进的分析平台,以满足越来越严格的评价标准的要求。
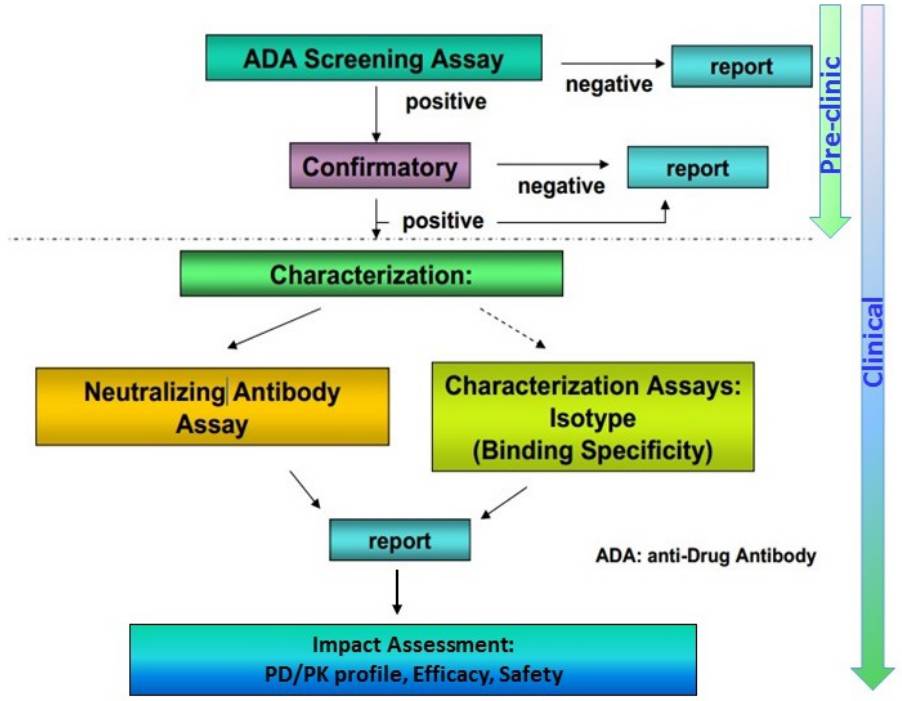
尽管现阶段免疫原性分析方法研究已经取得了长足的进步,但在实践中仍面临诸多重要的或关键性问题,包括:如何兼顾非临床及临床阶段研究方法的需求;如何选择及获取阳性对照(Positive Control,PC);是否需要或如何开展“稳定性”验证指标;如何降低药物或内源性分子对ADA研究方法的影响;如何评价不同分析平台研究结果的“不一致性”等。上述问题往往伴随着免疫原性研究的整个实践过程,需要在今后的研究中逐步的解决并完善。
在抗药性抗体分析方法规范性制定方面,EMA和FDA作为先行者已经推出了一系列相应的指南。EMA于2006年初次建议起草制定关于治疗性蛋白免疫原性评价指南,并于2008年4月生效(EMEA/CHMP/BMWP/14327/2006),2015年,EMA对2008版指南又进行更新改进,对分析策略部分进行更为详细地描述介绍,针对不同问题给出一定的解决方案和应对措施。基于单克隆抗体的特殊性,2012年,EMA专门针对单克隆抗体免疫原性分析制定出增补版指南。FDA于2009年首次推出治疗性蛋白免疫原性研究方法学开发指南草案,并于2016年又出台了新版本的免疫原性评估草案,FDA对旧版本的部分内容进行了修订。而我国目前尚没有免疫原性的相关指南。
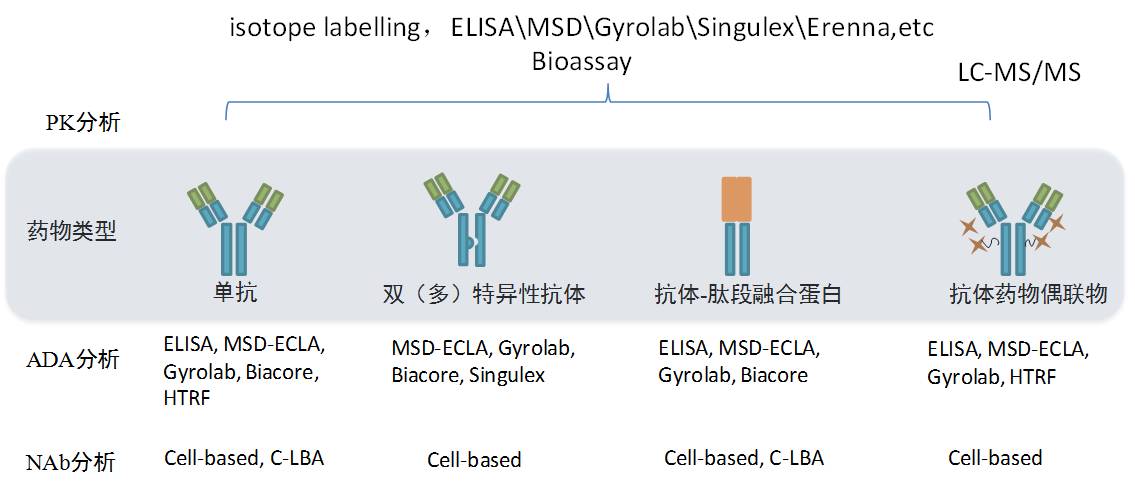
以抗体为主的生物技术药物已经成为越来越多的国内外大药企的选择方向,部分药企研发管线%为生物药物;尽管目前国内进行PK研究的CRO公司非常多,但是大多数仅依赖于经典的配体结合分析(Ligand Binding Assay, LBA),能够实现高端、多平台联合定量分析(图4)的公司主要集中在军科正源、上海益诺思、药明康德、科文斯、泰格、昭衍安评中心等,其中,有能力进行免疫原性研究的CRO公司主要以军科正源、药明康德、科文斯等为代表(图4)。更需要引起重视的是目前国内很多的CRO公司缺乏系统性规范性的平台建设,当然这需要在更长时间内进行更多经验的积累。尽管2015年药典中对生物分析方法学验证条目进行了系统性规定,但现阶段国内相关研究仍存在包括如何解读药典中的相关规定,如何指导在实践中的具体操作,分析平台缺乏系统性规范性建设等诸多问题。此外,我国目前还没有免疫原性的相关指南,我们也亟待尽快出台相应的行业或国家标准,以便于工业界,科研单位以及药物审评部门等能够有统一的标准,从而推动我国民族生物产业的进一步发展。
军科正源(北京)药物研究有限责任公司(UPP)以EMA、OECD、ISO/IEC17025、CFDA、USFDA、ICH法规为标准,建设了国内第一家专注于生物大分子药物分析的实验室,是中国首家、也是目前唯一一个在生物大分子药物方面通过CNAS认证的实验室。UPP拥有国际一流水平的生物技术药物/化学药物多平台检测系统,如ELISA,MSD-ECLA,Gyrolab,Biacore,Singulex Erenna System,LC-MS/MS,流式等。UPP技术实力雄厚,可提供各类生物大分子药物和化药的药代动力学、毒代动力学、免疫原性、药效学、等分析评价服务;涉及分子类型包括单抗、多肽、融合蛋白、激素、治疗性疫苗、核酸类药物、PEG化药物、ADC、纳米制剂、基因治疗制品、以及各类化药等。UPP技术团队完成了临床前临床研究项目近300项,覆盖了我国逾70%创新生物制品品种。承接项目范围涵盖临床前和临床;面对客户包括国内和国际:成功帮助客户取得了国内第一个ADC药物、PD1 抗体的临床批件,完成首个葡萄糖钳夹技术用于临床前胰岛素PK/PD评价;通过AMGEN、PFIZER、 AstraZeneca 、GSK等境外药企的FDAGLP标准核查。UPP出具的项目研究资料在CFDA新药审评中全部通过真实性、完整性核查,通过率达到100%。

军科正源实验室副主任,军事医学科学院药理学硕士。10年以上生物大分子药物药代动力学、毒代动力学、免疫原性研究经验,主要从事蛋白药物同位素(如碘125)标记、纯化、鉴定,蛋白药物在啮噬动物及非人灵长类动物体内的组织分布、代谢以及排泄研究;大分子药物在动物体内的药代动力学、毒代动力学、免疫原性研究,试验方案的设计、方法建立、方法学验证、生物样品分析、药代、毒代参数计算及结果分析,大分子药物临床研究阶段药代动力学及免疫原性研究设计,分析方法建立/验证,生物样品分析,参数计算及结果分析。